放大资金,增加盈利可能
配资是一种为投资者提供杠杆资金的金融服务!

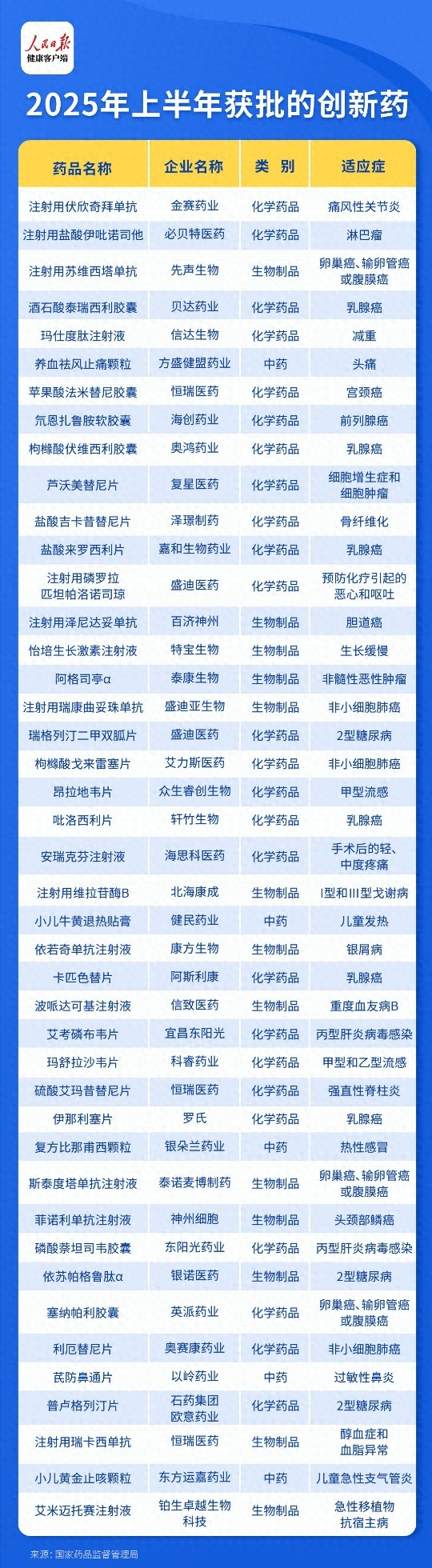
(人民日报健康客户端记者 赵萌萌 曹宇悦)据人民日报健康客户端记者不完全统计,2025年上半年,国家药品监督管理局共批准43款创新药,同比增长59%,创历史同期新高。其中,由中国企业研发制造的有40款,跨国企业研发进口3款,改革政策红利正在转化为产业发展动力。
抗肿瘤药物获批数量最多
获批的43款创新药包括化学药品24个,治疗用生物制品14个,中药5个;涵盖化学药、生物制品、中药三大类别,覆盖肿瘤、代谢性疾病、自身免疫病、罕见病等重大领域。
从治疗领域看,抗肿瘤药物的获批数量以18款独占鳌头,占比约40%。除了肿瘤领域,非肿瘤领域的创新药也呈现出全面开花的态势,在内分泌和代谢领域,信达玛仕度肽成为全球首个获批的GCG/GLP-1双受体激动减重药物。在自免领域,恒瑞医药的硫酸艾玛昔替尼片是中国首个自主研发的高选择性JAK1抑制剂。除此之外,麻醉、心血管、感染性疾病、罕见病亦有多款创新药成功获批。
从审评审批方面,共有11款药物通过优先审评通道上市,包含6款生物制品、4款化学药以及1款中药。涉及小儿黄金止咳颗粒、艾米迈托赛注射液、斯泰度塔单抗注射液、伊那利塞片、波哌达可基注射液、注射用维拉苷酶β、枸橼酸戈来雷塞片、芦沃美替尼片、注射用泽尼达妥单抗、注射用瑞康曲妥珠单抗、注射用盐酸伊吡诺司他。
新药审评审批流程不断提速
创新药的获批上市和国际化进程的加速,离不开政策红利的持续释放。临床试验是新药研发的重要环节。一款药品上市前,通常要经过Ⅰ期、Ⅱ期和Ⅲ期临床试验,逐步验证药品的安全性、副作用、有效性等。
早年间,从企业递交申请,到获批可以开展临床试验,中间可能长达一两年。到2018年,中国创新药审评审批改革提速,将这个时间缩短到60日。
2025年6月16日,国家药监局发布《关于优化创新药临床试验审评审批有关事项的公告(征求意见稿)》,拟将药品临床试验审评审批时限,从60日再次压缩至30日。
北京作为首批试点区域,已交出一份亮眼的成绩单。截至2025年4月,北京市已有9个试验项目纳入试点,8个项目获批临床试验。审评审批平均用时23.8个工作日,最短仅18个工作日,最高提速70%。
翔云优配官网提示:文章来自网络,不代表本站观点。